중2 과학-물질의 구성-불꽃반응 실험, 불꽃색, 원자와 빛의 스펙트럼의 관계
이전 글은
원자의 구조에 대하여 이야기 하였습니다
2023.01.15 - [과학/중학교 과학2] - 중2 과학 - 물질의 구성-원자의 구조. 원자핵, 전자 이야기, 원자모형의 변화
중2 과학 - 물질의 구성-원자의 구조. 원자핵, 전자 이야기, 원자모형의 변화
이전 글은 원소, 원자, 분자의 구분에 대한 내용이었습니다 2023.01.15 - [과학/중학교 과학2] - 중2 과학 - 물질의 구성 - 원소, 원자, 분자의 구분 중2 과학 - 물질의 구성 - 원소, 원자, 분자의 구분 이
musics.tistory.com
이번 글에서는
원소마다 다른 불꽃색에 대하여
이야기하고자 합니다
글의 순서는
1. 불꽃 반응실험, 불꽃색
2. 불꽃색이 나타나는 이유
3. 스펙트럼
입니다
1. 불꽃 반응실험, 불꽃색
1)불꽃 반응 실험
특정한 원소에 불꽃을 대면
불에 타는 원소에 따라
불꽃의 색이 다르게 나오는 현상을
확인하는 실험
(같은 색이 나오는 원소도 존재 합니다.)
2)불꽃색
원소마다 불꽃색이 존재하며
원소의 색이 같은 경우에
불꽃색을 이용하여 다른 원소인지 확인할 수 있습니다
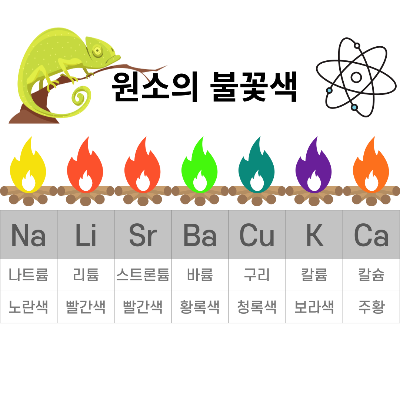
3)불꽃색의 예시
모든 원소의 불꽃색을 암기할 필요는 없습니다
중학생의 경우 학교에서 알려주는 색만 외우면 시험에 도움이 됩니다
아래 그림은 대표적인 원소의 불꽃색 입니다
2. 불꽃색이 나타나는 이유
먼저 논리적으로 생각해서
이유를 유추해봅니다
아마 원소마다 무언가가 달라서
'나오는 빛의 종류가 다르지 않을까?' 라고
생각할 수 있습니다.
그렇다면 원소마다 다른건 무엇이 있을 까요?
바로 원소마다
원자핵의 크기와 주변에 있는 전자의 갯수와 궤도가
차이가 납니다
불꽃색은 원자의모형 중
보어의 모형으로 설명이 가능합니다.
(현대모형으로도 설명이 가능하나,
이해가 어렵기에 보어로 설명합니다.)
일단 보어의 모형은
원자의 중심에 원자핵(+)가 있고,
주변에 전자가
특정한 궤도에서 돌고 있다는 모형입니다
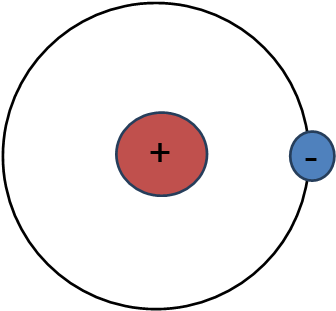
이때 원자핵의+와 전자의 -는
서로 당기는 힘(인력)이 존재하기 때문에
전자가 원자핵 주변에 붙잡혀서
돌고 있다고 생각하면 이해가 쉽습니다
여기서 이해해야 할 부분은
원자핵에 가까운 전자와 원자핵에서 먼 전자 중에
누가 더 에너지가 높을 것이냐는 겁니다.
(전자의 에너지가 중요합니다)
정답은 원자핵에서 거리가 먼 전자입니다
에너지가 높을수록
'전자가 잡아당기는 원자핵의 구속'에서
멀어질 수 있다고 생각하면
이해에 도움이 됩니다
즉, 에너지가 높아질수록
원자핵에서 먼궤도로 가게 됩니다
전자는 에너지를 흡수하여
안쪽 궤도에서 바깥쪽 궤도로 점프할 수 있고
에너지를 방출하면서
바깥쪽 궤도에서 안쪽 궤도로 점프할 수 있습니다
그렇다면 전자는
어떤 에너지를 흡수하거나 방출할 수 있을까요?
바로 빛입니다.
빛은 색(정확히는 빛의 주파수)에 따라서
가지는 에너지의 크기가 다릅니다
빛 중에서
전자가 궤도에서 다른궤도로 넘어가기 위해
필요한 에너지의 빛이 원자로 들어오면
전자가 빛을 흡수하여 바깥쪽궤도로 이동합니다
안쪽궤도로 이동할때는 그만큼의 에너지를
빛으로 방출하면서 이동합니다
이 원리를 불꽃색에 적용해 보겠습니다
불꽃을 원소에 가져가게 되면
원자의 전자들이 열을 받아 위의 궤도로 올라갑니다
올라간 전자들은 더 안정된 상태인 아래궤도로 내려가게 되는데
이때 궤도 사이의 에너지 차이만큼의 빛을 방출하게 되면서
불꽃색이 나타나게 됩니다
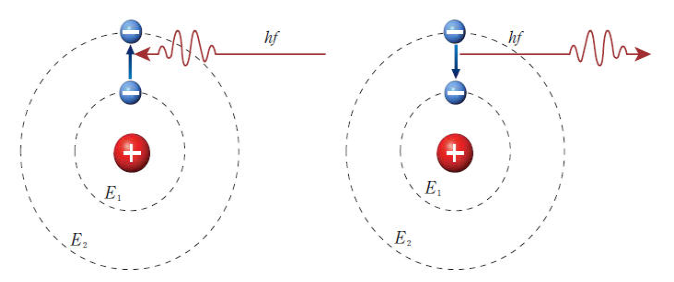
원자에 따른 불꽃색의 차이는 왜 생기는 것일까요?
원소마다 원자핵의 +크기가 다르기 때문에
궤도사이를 점프하기 위해 필요한 에너지량이 다릅니다
방출하는 에너지량에 따라 색이 다르므로
원소마다 보통 다른색의 빛이 방출되게 됩니다
참고로 실제로 원소에 흡수되거나 방출되는 빛은
한가지 종류가 아니지만
다양한 빛중 우리 눈에 보이는 빛(가시광선 영역의 빛)은
몇가지가 되지 않아 그 색으로 보이는 것입니다.
3. 스펙트럼
1)스펙트럼의 정의
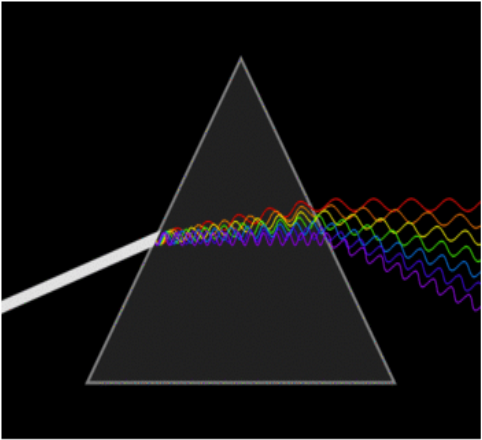
스펙트럼을 한국말로 표현하면 빛의 띠 입니다.
위쪽쪽 그림처럼 하나처럼보이는 투명한 빛은
사실 여러가지 색이 섞여서 무색으로 보이는 것입니다
분광기(프리즘) 등을 이용하여 빛을 분해하면
다양한 색이 섞여있음을 알 수 있습니다
이렇게 빛을 분해하여 보는 것을 스펙트럼이라고 합니다.
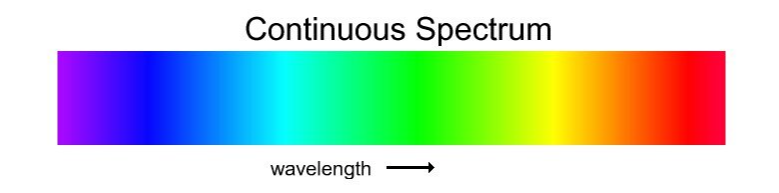
위에 있는 그림은 연속스펙트럼이라는 스펙트럼입니다
연속적으로 이어져있다는 의미를 가지듯이
모든 종류의 색이 들어있다고 생각하면 됩니다
2)스펙트럼의 종류
스펙트럼의 종류는
연속스펙트럼, 방출 스펙트럼, 흡수 스펙트럼으로
나눌 수 있습니다.
(1)연속스펙트럼
모든종류의 빛이 들어있어서
빈 곳이 없이 꽉찬 스펙트럼입니다
(2)방출스펙트럼
뜨겁게 달구어진(에너지가 높아진) 원자의 전자가
빛을 방출하면서 낮은 궤도로 내려올 때 나타나는
특정한 빛만 보이는 스펙트럼
(나머지 부분은 검게 표시합니다)
(3)흡수 스펙트럼
연속스펙트럼을 가지는 빛(다들어있는 빛이라고 표현하겠습니다)이
에너지가 낮은 원소를 통과하면서
원소의 전자들이 특정 부분을 흡수하여
그 부분만 비어있는 스펙트럼
(비어진 부분을 검은색으로 표시합니다)
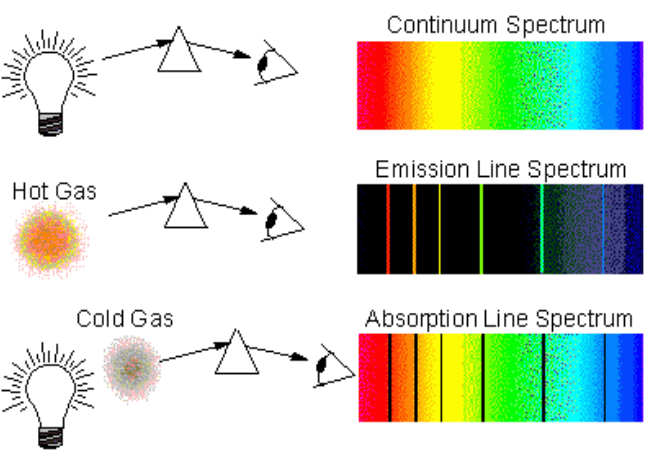
위 그림의
연속, 방출, 흡수 스펙트럼의
형태와 이유가 이해가 되신다면
제대로 원자의 구조를 이해하셨다고 생각합니다.
참고로 흡수나 방출 스펙트럼의
방출된(흡수된) 빛은 원소의 종류에 따라 다릅니다
이를 이용하여 우주에서 지구로 들어오는 빛을 조사하면
우주에 어떤 원소가 있는지를 알 수 있습니다.
마무리
이번글에서는
불꽃색에 대하여 설명하기 위해
원자의 모형을 가져오고
같은 원리로 설명이 가능한
원자의 스펙트럼에 대해 알아보았습니다.
이해가 굉장히 어려운 부분이기 때문에
한번에 이해가 되지 않을 수 있습니다.
다른 자료도 보시고 글도 다시 읽어보시면
이해에 도움이 되지 않을까 생각합니다.
도움이 되셨기를 바랍니다.
감사합니다.
함께보면 좋은 글은 원자의 구조와 원자모형 입니다
2023.01.15 - [과학/중학교 과학2] - 중2 과학 - 물질의 구성-원자의 구조. 원자핵, 전자 이야기, 원자모형의 변화
중2 과학 - 물질의 구성-원자의 구조. 원자핵, 전자 이야기, 원자모형의 변화
중학교 2학년 과학에서는 물질을 구성하는 가장 작은 입자(알갱이)를 원자라고 합니다 물론 현대과학에서 이 말은 정답이 아닙니다 더 깊은 영역이 있지만 중학교에서는 원자를 가장 작은 것으
musics.tistory.com