지난글에 이어지는 글입니다.
2023.02.10 - [과학/물리학] - 물리학-양자역학-쉽게 이해해보는 양자이야기, 보어의 원자모형, 전자의 에너지, 전자의 원자 탈출 1
물리학-양자역학-쉽게 이해해보는 양자이야기, 보어의 원자모형, 전자의 에너지, 전자의 원자 탈
이번글에서는 보어의 원자모형을 바탕으로 수소원자의 전자에 대해 이야기 하겠습니다 보통 양자역학이라고하면 '세상에서 제일 어려운학문' 이라든가 '제대로 이해한 사람은 없다' 등의 수식
musics.tistory.com
지난 글에서는 양자의 정의와
양자역학에대한 간략한 설명을 했습니다
이번 글의 내용은
보어의 원자모형으로 보는
수소 원자의 전자에너지의 양자화
입니다.
모드 물질은 원자로 구성 되어 있습니다
원자는 아주 작아 눈으로는 볼 수 없습니다
수 많은 과학자의 연구로
원자의 존재가 밝혀지고
원자의 구조도 예측이 가능해 졌습니다
이 글의 순서는
1. 보어의 원자 모형
2. 뤼드베리 상수, 방출 스펙트럼, 수소 스펙트럼
3.보어의 모형으로 설명하는 수소
입니다.
1. 보어의 원자 모형
1)보어 이전의 모형
보어 이전의 모형은
'행성형 모형'이라고 하겠습니다
+전하를 띄는 원자핵 주변을
-전하는 띄는 전자가
전기력 인력에 의하여 돌고 있다는 모형입니다
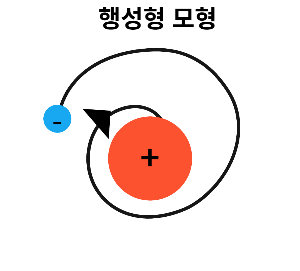
이 모형의 문제점은
행성처럼 운동하는 전자가
에너지를 조금씩 잃다보면
점점 궤도가 작아지다가
원자핵과 한다는 부분을
해결하지 못하였습니다
(실제로 충돌하지 않습니다)
2) 보어의 원자모형
보어는 행성형 모형에 가설을 하나 추가합니다
'전자는 특정한 궤도에서만 존재하며
궤도와 궤도 사이의 에너지는 연속이 아니다'
즉, 특정한 양의 에너지를 얻거나 잃지 않으면
전자는 특정 궤도에 계속 머물러 있는다
라는 주장입니다
이 내용은 이전글에서 말한
양자와 관련이 있습니다
'전자가 특정 궤도 사이를 오고 간다'
->'궤도 사이의 에너지 차이만큼 점프 한다'
->'전자의 에너지가 불연속이다'
->'전자의 에너지는 양자화 되어 있다'
이 논리적 과정이 전달이 되면 좋겠습니다
발표돤 보어의 원자모형은
뤼드베리 공식(1888년)과
맞아 떨어지는 결과를 보여 지지를 받습니다

2. 뤼드베리 공식, 방출 스펙트럼, 수소 스펙트럼
(순서: 스펙트럼, 수소 스펙트럼, 뤼드베리 공식)
1) 방출 스펙트럼
스펙트럼을 잘 아신다는 가정으로
글을 쓰려합니다
죄송하지만 스펙트럼의 정보는
2023.01.29 - [과학/중학교 과학2] - 중2 과학-물질의 구성-불꽃반응 실험, 불꽃색, 원자와 빛의 스펙트럼의 관계
중2 과학-물질의 구성-불꽃반응 실험, 불꽃색, 원자와 빛의 스펙트럼의 관계
이번글에서 다룰 내용은 -불꽃반응 실험, 불꽃색 -불꽃색이 나타나는 이유 -스펙트럼 등을 원자의구조(보어모형)으로 설명하려합니다. 1. 불꽃 반응실험, 불꽃색 1)불꽃 반응 실험 특정한 원소에
musics.tistory.com
를 참고 부탁드립니다
방출 스펙트럼은
입자를 가열한 뒤
온도가 내려가면서 방출되는
빛을 보는 방식입니다
방출 스펙트럼은 보통
검은 바탕에 검출된 빛들이 선으로 나와서
선스펙트럼 이라고도 불립니다
포인트는 방출스펙트럼을 이용하면
특정 원자가 방출하는 빛을 볼 수 있습니다
이는 원자마다 내보내는 빛이 다르다는
사실을 알려줍니다
2) 수소의 스펙트럼
많은 과학자들이
수소의 스펙트럼을 검출 실험을 합니다
수소를 선택한 이유는 아마도
전자가 한 개라서 일 듯합니다
(정확한 이유는 모릅니다^^)
가장 유명한 학자들은
라이먼, 발머, 파셴 입니다
이들은 각각 수소에서 발생하는
자외선(라이먼)
가시광선(발머)
적외선(파셴)
을 찾아 냅니다

특히 발머의 경우는
나오는 빛들의 파장 차이를
공식화 합니다
추후 이 공식을 바탕으로
뤼드베리 공식이 탄생합니다
3)뤼드베리 공식
뤼드베리는 이전까지 발표된
수소스펙트럼들의 파장을 정리합니다
그리고 모든 파장의 규칙성을 묶어
정수에 따른 파장을 구하는 식을 발표합니다
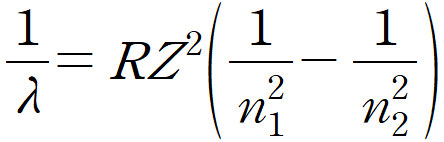
는 방출되는 빛의 파장을 의미 합니다
(람다라고 보통 읽습니다)
R은 뤼드베리상수입니다
(정해진 수 입니다)
Z는 원자번호(수소는 1)입니다
n1과 n2는 각각 정수로
상태를 의미한다고 이해하면 편합니다
(n2>n1이라는 가정이 필요합니다)
즉 2번상대에서 1번상태가 되면
2->1 상태가 된다
즉 n2=2, n1=1 이 됩니다
공식을 해석하면 이렇습니다
수소가 가지는 상태가 여러개 있고
상태가 변할 때 빛이 나온다
즉, 상태 사이에 에너지가 정해져 있다
3. 보어의 원자 모형과 뤼드베리 공식
1)보어의 원자 모형의
뤼드베리 공식의 설명
보어의 원자 모형에서의 수소는
가운데 원자핵이 있고 전자 한개가
특정 궤도에 있습니다
뤼드베리 공식에 의하면
수소 원자는 특정 상태에 따른
에너지 차이가 있습니다
그렇다면 에너지 차이를 만들 수 있는건
원자핵이 아닌 전자라는 것입니다
(원자핵은 움직이지 않기 떄문입니다)
즉, '수소의 에너지 상태는
전자가 결정하고
그 상태는 전자의 궤도가 결정한다'
라는 가정이 가능합니다
이 가정은 뤼드베리 공식을
완벽히 설명이 가능하고
상태인 n의 숫자를
궤도넘버로 볼 수 있습니다
(양자에서는 주양자수 라고 부릅니다)
즉 n=1은 가장 안쪽 궤도
n=2는 두번째 궤도
n=3은 세번쨰 궤도
이런식으로 가능하고
에너지를 받은 전자가
아주 높은 궤도로 올라가서
아래궤도로 떨어지면
에너지가 줄어들고
그 감소하는 에너지를
빛으로 방출한다
그 방출된 빛을 본게
'수소 스펙트럼' 이다
이렇게 하면
모든게 맞아 떨어지게 됩니다
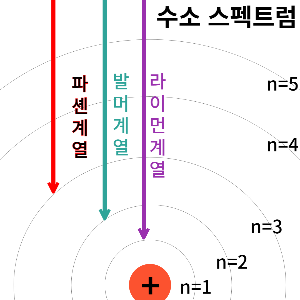
이후 찾아낸 결론은
라이먼 계열은 높은 궤도들에서
n=1인 궤도로 떨어질 때의 빛
(가장 높은 에너지 라서 자외선)
발머 계열은 높은 궤도들에서
n=2인 궤도로 떨어질 때의 빛
(자외선보다 에너지가 낮은 가시광선)
파셴 계열은 높은 궤도들에서
n=3인 궤도로 떨어질 때의 빛
(가시광선보다 에너지가 낮은 적외선)
이라는 결론 입니다
보어 모형은 수소 원자의 전자가
궤도를 옮겨다니기 때문에
에너지 상태가 연속적이 아닌 불연속이라
양자화 되어 있다는 것을 보여주며
수소의 스펙트럼을 완벽히 설명합니다
물론 현대모형은 이런 보어모형에서
추가적으로 변하게 되지만
보어 모형은 많은 것을 알려줍니다
추가 적으로 n=∞인 경우
전자가 원자핵의 구속력을 뚫고
밖으로 나가게 되는 경우 입니다
뤼드베리 공식에 넣어보면
n=1의 전자가 수소원자를 탈출하려면
약 13.6eV 민큼의의 에너지가 필요합니다
(단위가 좀 특이합니다..)
'과학 > 물리학' 카테고리의 다른 글
| 물리학-양자역학-쉽게 이해해보는 양자이야기, 보어의 원자모형, 전자의 에너지, 전자의 원자 탈출 1편 (0) | 2023.02.10 |
|---|

댓글